Как работают батарейки и аккумуляторы
Для каждого нового опыта с бутылками нам приходилось переливать воду из правой в левую. Для чего? А для того, чтобы создать разность уровней, чтобы возник ток воды в шланге. Постепенно вода перетекала из левой бутылки в правую, уровни сравнивались и ток прекращался. Мы снова переливали воду, и процесс начинался заново. Значит, идея такова: чтобы ток воды не прекращался, надо постоянно поддерживать разность уровней воды.
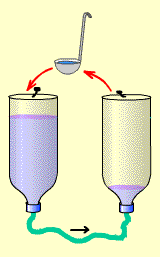
Попробуем! Для этого надо взять какой-нибудь черпачок, например - кофейную чашечку. Этим черпачком мы будем вычерпывать воду из правой бутылки, и выливать её в левую. Причем надо вычерпывать с такой скоростью, чтобы количество переливаемой воды было не меньше количества поступающей по шлангу за то же время. Иначе, если отчерпывать меньше, чем за то же время переливается по шлангу - через некоторое время уровни все равно сравняются и ток прекратится.
Переходим к электричеству.
Итак, у нас есть две заряженные гайки от трактора Беларусь. Или лучше, давайте возьмем просто две металлические пластины. Потенциал одной - 10 В, другой - 15 В. Между ними напряжение - 5В. Подключаем к ним лампочку. Лампочка светится, ток идет. Идет, идет, идет? И вот уже не идет, и лампочка не горит! Почему? А потому что ток уровнял потенциалы двух пластин, и напряжение между ними стало 0В.
Чтобы лампочка загорелась снова, надо что? Надо перенести заряд с одной пластины на другую и тем самым снова создать разность потенциалов. Для этого надо привлечь к работе какие-то сторонние силы, которые бы занялись перекачкой зарядов. В опыте с бутылками этой сторонней силой являлся тот, кто вычерпывал воду. В электротехнике такой силой может служить, например, химическая реакция.
Любая батарейка или аккумулятор - это ни что иное, как две металлические пластины, помещенные в специальное химическое вещество - электролит. Одна пластина подключена к выводу "+", другая - к выводу "-". Допустим, батарейка рассчитана на 9 Вольт. Пока ее не трогают, напряжение между пластинами остается равным 9В. Но стоит подключить к батарейке нагрузку, например, лампочку, как от пластины "+" к пластине "-" потечет ток. Напряжение начнет уменьшаться. И тут же "включится" химическая реакция в электролите, которая начнет перекидывать электроны с "-" (отрицательной) пластины обратно на положительную, поддерживая тем самым разность потенциалов между ними. Чем больше сила тока в нагрузке (чем больше мощность лампочки), тем интенсивнее будет протекать реакция.
Все реакции можно делить на две большие группы: те, в результате которых выделяется энергия, и те, для проведения которых необходима энергия извне. Реакция внутри батарейки относится к первому типу. К этому же типу относится реакция горения. При горении, в результате соединения молекулы топлива с кислородом, выделяется энергия в виде тепла и света, и образуется новое вещество - окисленное топливо. Например, если топливом является уголь (состоящий, в-основном, из углерода) - при соединении с воздухом получается оксид углерода (углекислый газ). Углекислый газ не горит, и его мы больше использовать не можем. То есть - он является отходом, бесполезным продуктом реакции. По мере горения, количество исходных веществ (топлива и кислорода) уменьшается, а количество бесполезного продукта (углекислого газа) увеличивается. В конечном итоге, наступает момент, когда продукты реакции сгорают полностью, и реакция прекращается.
В электролите тоже протекает реакция, в ходе которой выделяется энергия в виде электрического тока. При этом, расходуются исходные вещества, и выделяется бесполезный продукт. Чем меньше остается расходных веществ - тем тяжелее батарейке поддерживать нужное напряжение между пластинами. Батарейка "садится".
Мы уже делили все реакции на два вида. Поделим еще раз, но по-другому.
Реакции бывают обратимыми и необратимыми.
Если продукт реакции можно снова преобразовать в исходные вещества - то такая реакция обратима. То есть, она идет "в обе стороны".
Если в результате реакции получается продукт, который нельзя преобразовать обратно, то реакция необратима.
"Фарш невозможно провернуть назад И мясо из котлет не восстановишь?"
Чем отличается батарейка от аккумулятора? Тем что батарейку нельзя заряжать, а аккумулятор - можно. То есть, в батарейке протекает необратимая реакция, а в аккумуляторе - обратимая. Когда мы подключаем аккумулятор к зарядному устройству, ток внутри него начинает течь в обратном направлении, то есть - от "+" к "-". И реакция в электролите также начинает идти в обратном направлении. В результате, продукт реакции разлагается на исходные вещества. Аккумулятор "заряжается"
Пожалуй, это все о батарейках и аккумуляторах.
Источник: РадиоКотВернуться к списку схем, категория "Начинающим"


 CHIPINFO - принципиальные схемы электронных устройств. Категория Начинающим
CHIPINFO - принципиальные схемы электронных устройств. Категория Начинающим